Je réponds aujourd’hui à l’excellente question d’Amina qui va me permettre d’expliquer un tas de choses et d’assumer au grand jour ma passion pour les GIFs animés !
Les molécules sont des assemblages d’atomes, attachés les uns aux autres par des forces de liaison. Les molécules les plus simples sont composées de deux atomes, comme le dioxygène que tu respires. D’autres molécules plus complexes sont composées de centaines ou de milliers d’atomes. Quant aux molécules d’ADN contenues dans chacune des cellules de ton corps, elles comportent des milliards d’atomes ! Mais ce n’est pas aussi compliqué qu’il n’y parait : assembler des atomes ressemble un peu à un jeu de montage microscopique, avec certaines règles à respecter. Voyons comment tout cela marche, en commençant par considérer les “briques” élémentaires de ce jeu : les atomes.
Les atomes
Les atomes sont comme de minuscules billes qui composent toute la matière ordinaire ; ton corps, l’air que tu respires, tes doigts de pied, les chaussettes que tu portes, les microbes, le chat du voisin, Barack Obama, la Terre et tout ce qu’il y a chez toi : tout cela est composé d’atomes. Les atomes sont si petits que tu pourrais en ranger un milliard en file indienne sur une règle de 30 centimètres. Ils sont si légers, qu’il faudrait un milliard de files indiennes d’un milliard d’atomes pour faire un milliardième de kilogrammes (tu as suivi ?) ! Mais les atomes sont aussi incroyablement solides : il est presque impossible de les casser. Les atomes n’ont pas tous la même taille, il en existe environ 118 différents ! J’écris “environ” car on en découvre/fabrique régulièrement des nouveaux. C’est peu si l’on considère l’extraordinaire variété des formes du monde dans lequel nous vivons !
Les atomes sont eux-mêmes composés de protons (des particules de charge électrique positive), de neutrons (des particules de charge électrique neutre) et d’électrons (des particules de charge électrique négative). Les protons et les neutrons sont concentrés au centre de l’atome et forment le noyau. Les électrons, qui sont bien plus petits, forment une sorte de nuage diffus qui entoure le noyau. Comme les atomes sont électriquement neutres, ils ont le même nombre de protons et d’électrons. L’atome le plus simple est l’atome d’hydrogène, il possède un seul proton, et donc un seul électron. L’oxygène est un atome plus grand : il possède 8 protons (et donc 8 électrons). L’uranium quant à lui, possède 92 protons, ce qui en fait un élément presque aussi lourd que Patrick Sébastien.
Les électrons sont classiquement représentés comme gravitants autour du noyau. Ils “tournent” sur des couches concentriques, très loin du noyau (pour des questions de facilité, les schémas ci-dessous ne sont pas du tout à l’échelle).
 |
| De gauche à droite : représentation usuelle de la structure électronique des atomes d’Hydrogène, d’Oxygène et d’Uranium. |
Les électrons sont obligés de rester dans leurs couches respectives et ne peuvent pas être quelque part entre deux couches. Les couches ne peuvent accueillir qu’un nombre précis d’électrons. La première couche est appelée K, elle est réservée aux veinards qui côtoient le noyau au plus près. Il n’y a de la place que pour deux électrons sur cette couche. Plus loin, on trouve la couche L qui peut accueillir 8 électrons. Encore plus loin se trouve la couche M où 18 électrons peuvent loger et ainsi de suite jusqu’à la couche P qui a une capacité maximale de 72 électrons. Dans le schéma ci-dessous, seules les trois premières couches sont représentées.
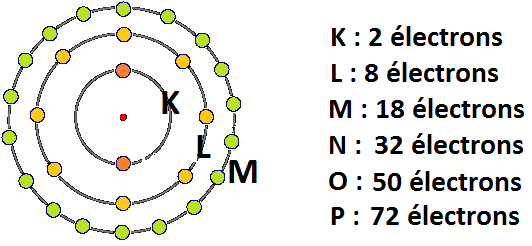 |
| Schéma des trois premières couches électroniques |
Pour les curieux, le nombre d’électrons Ne qu’une couche peut accueillir est égale à 2n² où n est le numéro de la couche (n = 1 pour la couche K, n = 2 pour la couche L etc.). Quant à la désignation par lettres, elle vient du fait que la première couche fut appelée K pour Kern qui signifie Noyau en allemand.
La formation des liaisons atomiques
Si je te bassine avec ces histoires de couche électronique, c’est que ce sont les électrons situés sur la couche la plus éloignée du noyau (la couche externe) qui vont créer des liaisons atomiques. Pour s’attacher l’un à l’autre, des atomes vont partager les électrons de leurs couches externes respectives.
Il existe quelques règles simples pour cela. Lorsqu’une liaison se forme, chaque atome met en commun le même nombre d’électrons. C’est comme si les atomes se donnaient la main : chaque atome doit tendre la main vers l’autre, en donnant le même nombre d’électrons. Des atomes dont la couche externe est incomplète vont chercher à la compléter, car un atome dont la couche externe est pleine devient plus stable. En revanche, un atome qui a une couche externe occupée au maximum (on dit qu’elle est saturée) ne cherchera pas à former des liaisons. Le nombre d’électrons sur la dernière couche va donc présider à la formation ou non d’assemblages d’atomes. L’atome d’oxygène par exemple, qu’on a vu un peu plus haut, possède 6 électrons sur sa couche externe (la couche L) alors qu’il pourrait en avoir 8. Il va donc essayer de trouver deux électrons quelque part. C’est pourquoi l’oxygène est un élément très réactif qui n’est presque jamais seul. L’atome d’hydrogène, lui, n’a qu’un seul électron sur sa couche externe, alors qu’il voudrait en avoir deux. L’atome d’oxygène peut donc s’associer à deux atomes d’hydrogène, qui vont partager chacun un électron, et former ainsi une molécule d’eau :
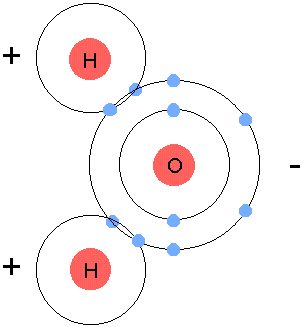 |
| Molécule d’eau. Crédits : Michael Gregory |
Dans la molécule d’eau, le nuage d’électrons externes se déforme vers l’oxygène, créant un pole négatif et deux pôles positifs dans la molécule. On dit que la molécule est polaire. L’oxygène peut aussi s’associer avec n’importe quel autre atome qui serait prêt à lâcher deux électrons. Il peut même s’associer à lui même, pour former du dioxygène. Pour cela, chaque atome met en commun deux électrons pour former la liaison, il s’agit donc d’une liaison double :
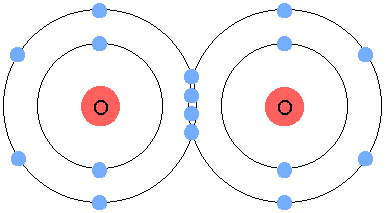 |
| Molécule de dioxygène. Crédits : Michael Gregory |
Voici une image un peu plus réaliste de ce qui se passe quand deux atomes d’oxygène se lient pour former une molécule de dioxygène. Ici, les électrons sont représentés par un nuage diffus rouge-orangé :
 |
| Formation de la molécule de dioxygène |
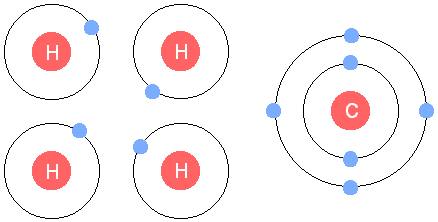 |
| 4 atomes d’Hydrogène et un atome de Carbone. Crédits : Michael Gregory |
 |
| Molécule de méthane. Crédits : Michael Gregory |
Les molécules
 |
| Molécule de Buckminsterfullerene |
Le rôle des molécules
 |
| Structure d’un fragment d’ADN |
Les molécules sont présentes partout. Elles constituent les substances que nous mangeons et que nous utilisons tous les jours. La plupart des molécules sontnaturelles, c’est à dire qu’elles se forment spontanément dans la nature, ou qu’elles sont synthétisées par des organismes vivants : l’hémoglobine dans notre sang ou la chlorophylle des plantes vertes par exemple. Les molécules jouent aussi un rôle indispensable dans le développement de la vie. Notre ADNest une molécule géante constituée de milliards d’unités de base, qui a la forme d’une échelle enroulée, comme sur la figure ci-contre. Toutes les substances qui interviennent dans notre corps sont des molécules, souvent très complexes : enzymes, protéines, hormones etc. Pour comprendre comment ces molécules fonctionnent et quel est leur rôle dans l’organisme, il faut savoir comment elles sont construites. C’est ce qu’essaient de faire les spécialistes en biologie moléculaire.
Des molécules synthétiques
L’Homme a aussi appris à fabriquer lui même des molécules. Parfois, il est en effet plus facile et moins cher de synthétiser une molécule plutôt que de l’extraire d’un produit naturel. C’est le cas de la vanilline par exemple, la molécule qui donne son goût à la vanille. L’Homme a aussi entièrement crée de nouvelles molécules. Les polymères par exemple, sont des molécules en chaînes extrêmement longues qui forment certains plastiques, des peintures ou des résines. D’autres molécules ont été créées pour rendre tes chaussures imperméables, les poêles anti-adhésives, pour parfumer les bonbons ou pour donner un goût bizarre au coca zéro. Certaines molécules synthétiques se sont avérées dangereuses pour l’Homme et la nature. On peut citer, entre autres, les pesticides, les engrais chimiques, les gaz à effet de serre ou plus récemment le bisphénol A. Cela ne veut pas dire que toutes les molécules synthétiques sont dangereuses, simplement qu’il faut faire attention. A l’inverse, certaines molécules naturelles sont toxiques ou dangereuses pour l’Homme. Le dichlore, l’ozone et le monoxyde de carbone par exemple, sont des gaz toxiques voire mortels. Si tu t’es déjà fait piquer par une guêpe, tu sais que la nature peut produire des molécules très désagréables ! Et c’est loin d’être la pire expérience de ce genre !
 |
| Molécule d’Aspirine |
L’industrie pharmaceutique travaille également avec des molécules : tous les médicaments que tu prends sont des molécules qui ont été soit découvertes plus ou moins par hasard (parfois par des pharmaciens toxicomanes), soit fabriquées dans un but bien spécifique. L’aspirine par exemple, dont la représentation est donnée ci-dessus, a été une des premières molécules synthétisée en laboratoire, en 1859. Fabriquer une nouvelle molécule qui a les propriétés souhaitées est quelque-chose de très compliqué, les labos pharmaceutiques passent des années, voire des dizaines d’années sur l’étude d’un seul médicament. Cela ne justifie pas du tout le prix exorbitant auquel ils sont vendus, ni la réélection de Patrick Balkany dans les Hauts-de-Seine, mais on ne fait pas de politique sur ce blog. À mort le capitalisme. Hem. Bref.
Voilà Amina, j’espère que j’ai à peu près réussi à t’expliquer ce qu’est une molécule. Si ce n’est pas le cas, n’hésite pas à me le faire savoir. Tu peux aussi te consoler avec ces GIFs que j’ai jugés trop distrayants pour être casés ailleurs qu’à la fin de l’article.




